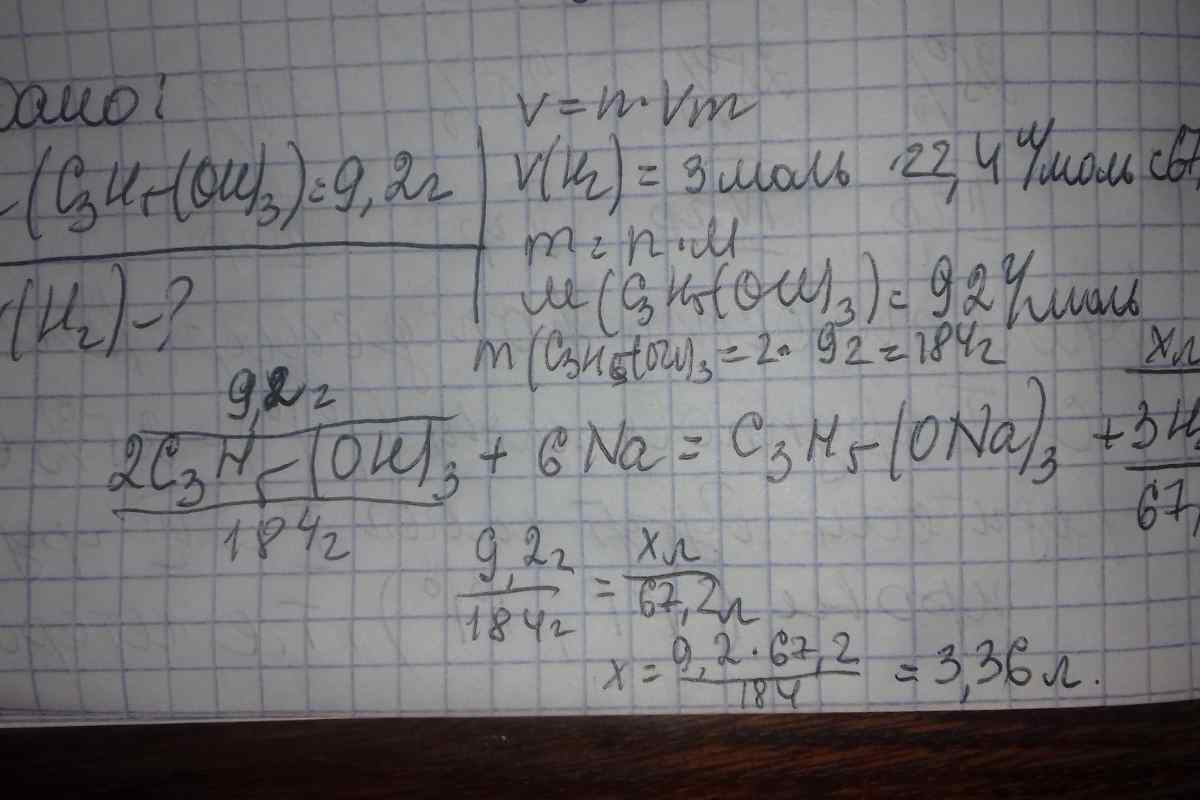Еквівалентною масою, або молярною масою еквівалента, називається кількість речовини, що взаємодіє з одним молем водню або витісняють стільки ж атомів водню з його сполук. Позначається ця величина Мекв, вимірюється в м/моль і обчислюється за формулами або експериментальним шляхом.
Вам знадобиться
- - періодична система;
- калькулятор;
- - хімічний посуд;
- - розбавлена соляна кислота;
- - навіска металу.
Інструкція
1. Щоб знайти еквівалентну масу простої речовини, скористайтеся формулою:Мекв = Ma/B, де Мекв - маса еквівалента; Ма - атомна маса елемента; B - валентність. Наприклад, згідно з формулою еквівалентна маса натрію дорівнюватиме 22,99 г/моль, а двовалентної сірки - 32/2 = 16 г/моль тощо. Для складних речовин молярною масою еквівалента буде називатися кількість речовини, що прореагувала без залишку з одним еквівалентом іншої речовини, наприклад, водню.
2. Пам 'ятайте, що розрахунок цієї величини для різних хімічних сполук має нюанси. Наприклад, при обчисленні еквівалентної маси оксидів - складайте значення еквівалентних мас, що становлять з 'єднання. Припустимо, дано оксид цинку. Спочатку вважаєте Мекв (Zn) = 65/2 = 32,5 г/моль. Потім - Мекв (O) = 16/2 = 8 г/моль. Таким чином, отримаєте еквівалентну масу ZnO рівну 40,5 г/моль. А розрахувати масу еквівалента кислоти можна, розділивши її молекулярну масу на кількість атомів водню, що містяться в ній: Мекв (H2SO4) = 98/2 = 49 г/моль тощо.
3. Для експериментального визначення еквівалентної маси спочатку повторіть техніку безпеки при роботі з кислотами і газами. Потім візьміть бюретку, пробірку і воронку. З 'єднайте їх між собою гумовими трубками. Налийте в бюретку дистильованої води, за допомогою вирви встановіть її рівень на нулі.
4. У пробірку налийте 5 мл соляної кислоти (постарайтеся не замочити стінки). На суху стінку помістіть навіску металу. Слідкуйте за тим, щоб він не впав у кислоту завчасно. Закрийте пробірку пробкою і струсіть. Водень витіснятиме воду з бюретки. Після завершення реакції вирівняйте рівень води в бюретці і воронці. Запишіть кінцевий результат, температуру і тиск при проведенні досвіду.
5. Визначте витіснений обсяг водню, порівнявши початковий і кінцевий рівень води в бюретці. Наведіть отриманий результат до нормальних умов, використовуючи показання барометра і термометра. І потім тільки розрахуйте масу еквівалента металу, використовуючи формулу:m (металу )/V (водню при норм.умовах) = Мекв. (металу )/Vекв (водню).