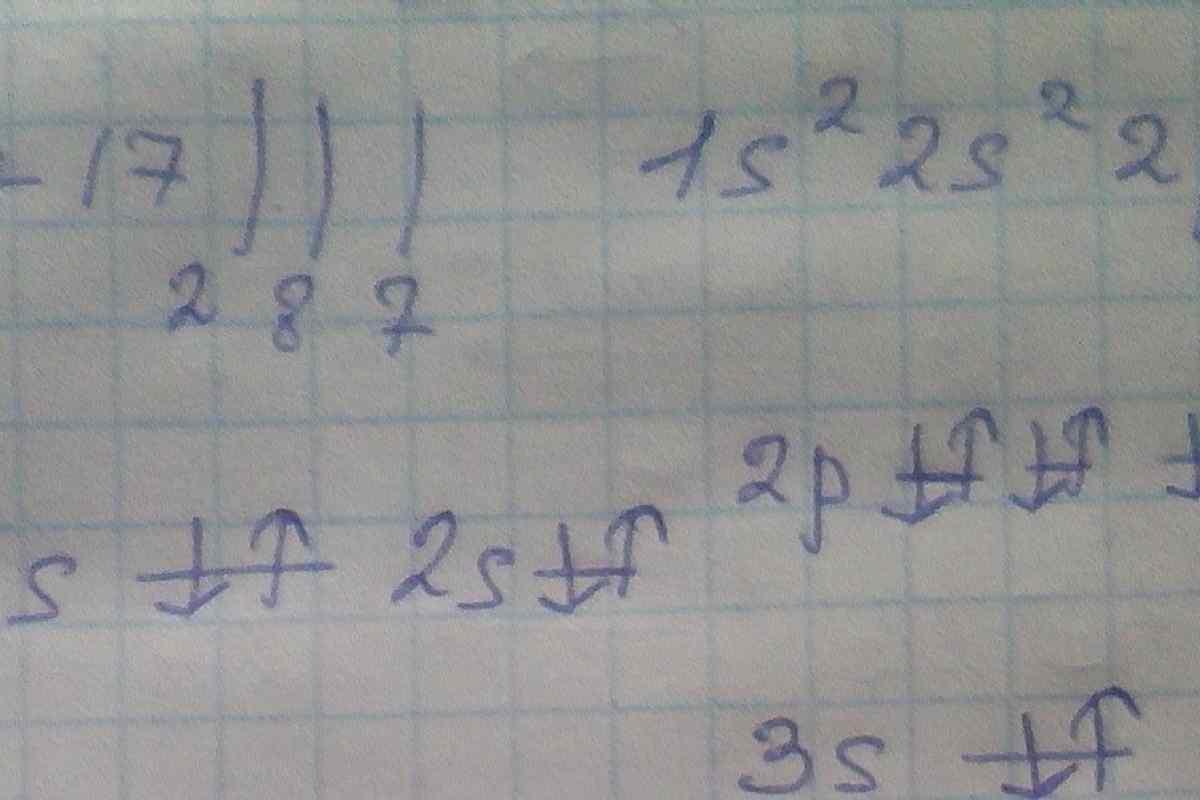Хімічні реакції не зачіпають ядра атомів. Хімічні властивості елементів залежать від будови їх електронних оболонок. Стан електронів в атомі описується чотирма квантовими числами, принципом Паулі, правилом Гунда і принципом найменшої енергії.
Інструкція
зарядядра атома1. Подивіться на комірку елемента в таблиці Менделєєва. Порядковий номер вказує цього елемента, а також число електронів в атомі, оскільки в основному стані атом електрично нейтральний. Як правило, порядковий номер пишеться зверху ліворуч від найменування елемента. Це ціле число, не плутайте його з масовим числом елемента.
2. Спочатку електрони заповнюють перший енергетичний рівень, що містить тільки 1s-подуровень. s-подуровень може містити не більше двох електронів, причому вони повинні відрізнятися напрямками спину. Квантову комірку зобразіть за допомогою прямокутника або невеликого відрізка. У комірку помістіть дві різноспрямовані стрілки - смотрящу вгору і вниз. Так ви символічно позначили два електрони на s-підрівні першого енергетичного рівня.
3. Другий енергетичний рівень містить один осередок s-подурівня і три осередки p-подурівня. На p-орбіталі може перебувати до шести електронів. Ці три комірки заповнюються послідовно: спочатку по одному електрону в кожній, потім ще по одному. Згідно з правилом Гунда, електрони розташовуються так, щоб сумарний спин був максимальним.
4. Третій енергетичний рівень заповнюється, починаючи з натрію, що має 11 електронів. Існує подуровень 3d, але він буде заповнюватися електронами тільки після комірки 4s. Така поведінка електронів пояснюється принципом найменшої енергії: кожен електрон прагне до такого розташування в атомі, щоб його енергія була мінімальною. А енергія електрона на подурівні 4s менша, ніж на 3d.
5. Взагалі, заповнення електронами енергетичних рівнів відбувається в такій послідовності: 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d. При цьому на будь-якій s-оболонці може перебувати не більше двох електронів (одна орбіталь), на p-оболонці - не більше шести електронів (три орбіталі), на d-подурівні - не більше 10 (п 'ять орбіталів), на f-подурівні - не більше 14 (сім орбіталів).