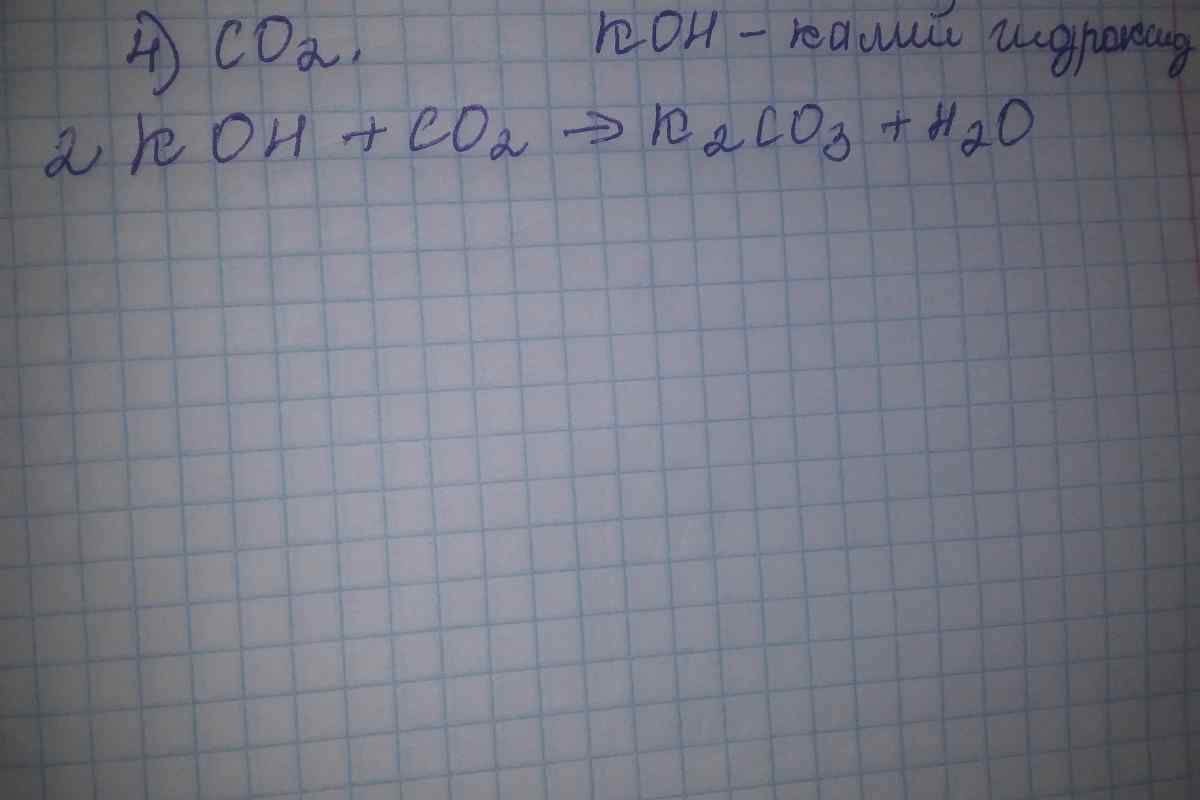Рівняння хімічних реакцій - одна з найважливіших складових частин курсу хімії в будь-якому освітньому закладі. Взаємодія кислот з підставами - це досить поширене завдання при різних видах перевірки знань - на самостійних і контрольних роботах, а також під час тестування.
Вам знадобиться
- - сірчана і соляна кислоти;
- - гідроксиди калію та міді;
- - фенолфталеїн.
Інструкція
1. Кислоти становлять складні речовини, що складаються з двох частин - атомів водню і кислотних залишків. Кислоти можуть бути розчинними у воді і нерозчинними. До підстав відносять сполуки, які також мають у своєму складі дві частини - атоми металів і гідроксильні групи. Число гідроксогруп співпаде з валентністю металу.
2. Хімічна реакція між кислотою і основою, в результаті якої утворюються сіль і вода, називається реакцією нейтралізації. Цей хімічний процес відносять до реакції обміну, в якій кислоти і підстави обмінюються своїми складовими частинами. З розчинними у воді кислотами можуть взаємодіяти будь-які (як розчинні, так і нерозчинні у воді) підстави.
3. Приклад № 1. Напишіть реакцію взаємодії соляної кислоти з гідроксидом калію. У лівій частині рівняння запишіть речовини, що вступають у реакцію:HCl + KOH = Складові частини речовин обмінюватимуться своїми частинами - на місце атома водню встане атом металу - калій. Звільнений водень з 'єднається з гідроксильною групою, утворюючи при цьому молекулу води:HCl + КOH =КCl + H2O
4. Візуально ознаки реакції помітити неможливо, оскільки розчини кислоти і підстави прозорі. Однак досвідченим шляхом можна довести, що нейтралізація все ж відбулася. Для цього налийте в пробірку 2 мл гідроксиду калію і помістіть в неї смужку індикатора - фенолфталеїну. У лужному середовищі він відразу поміняє забарвлення на малинове. Прилейте в пробірку стільки ж соляної кислоти і індикатор знебарвиться. Це свідчить про те, що лужі в пробірці вже не залишилося, а відбулася нейтралізація її кислотою, тобто утворилися сіль і вода.
5. Приклад № 2. Напишіть рівняння реакції взаємодії гідроксиду міді із сірчаною кислотою. Свіжоприготовлений гідроксид міді являє собою нерозчинну у воді речовину блакитного кольору. Для проведення реакції візьміть 1 мл осаду і прилейте до нього 2 мл сірчаної кислоти. В результаті реакції осад розчиниться, а отриманий розчин стане блакитного колір за рахунок утворення сульфату міді і води. На місце водню в кислоті встане атом міді, а водень з 'єднається з гідроксогрупою, утворюючи молекулу води. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O